周波数変調原子間力顕微鏡(FM-AFM)をベースとする3次元フォースマップ法は、水和構造や電荷分布を直接可視化する強力な手法ではあるが、その主な計測範囲は探針が試料と部分的に接触してから非接触に至るまでの領域となる。一方、分子間相互作用力検出のためには、相互作用が強くはたらく領域(特異結合領域)での測定が必要となるが、その有効作用時間は極めて短く、検出確率が著しく低くなることから、測定法の本質的な改善が求められていた。
本研究課題では、高感度・高分解能FM-AFMを動作基盤とする3次元フォースマップ技術をさらに高度化し、AFM探針の精密運動制御法を新たに開発するとともに、応答信号の実時間運動解析を取り入れることで、複雑な立体構造をもつ生体分子に対しても安定なフォースマップ測定を実現する。これにより、生体分子の極近傍領域の水和構造力・電荷密度・揺らぎ分布の可視化、さらには単一分子レベルでの生体分子間認識・相互作用計測を可能とし(図1参照)、固液界面物性という物理的視点に立脚した、新たな分子機能イメージング法を確立するとともに、細胞生理機能における微視的役割を解明する。
3次元フォースマップ法の高度化
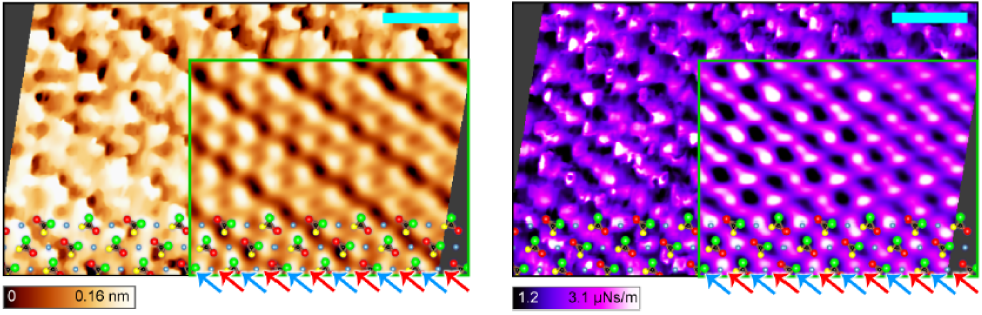
生体分子近傍においては、水分子が構造化されていることが知られており、さらにはイオンが電気2重層と呼ばれる構造を形成することが知られている。われわれはFM-AFMを用いることで、構造化された水分子と電気2重層を同時に分離して検出することに成功した。試料としては、正帯電の領域と負帯電の領域を持つケイ酸塩結晶を用いた。
K. Umeda, L. Zivanovic, K. Kobayashi, J. Ritala, H. Kominami, P. Spijker, A. S. Foster, H. Yamada Nature Communications 8, 2111 (2017).
生体分子間認識・相互作用の可視化
生体機能は非常に複雑なシステムによって構築されており、その中でも生体分子の認識機構や相互作用は、信号伝達やエネルギー変換などに密接に寄与している。
抗体分子の特異的結合
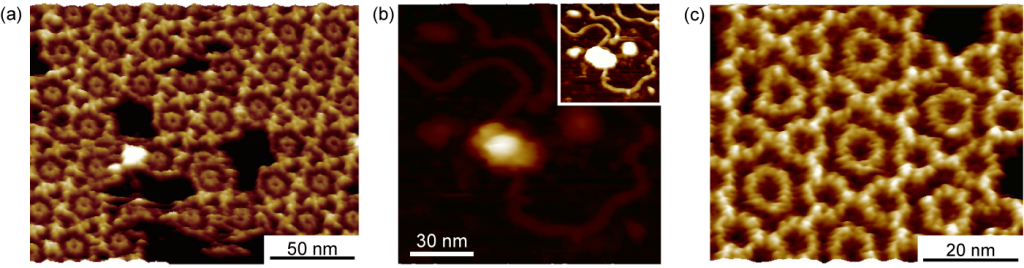
抗原-抗体反応は生体分子における特異的結合の代表例として知られており、バイオセンサなどのデバイスへの応用や医療における応用が盛んに為されている。これまでに、われわれのグループではY字型の構造を有するIgG抗体分子が6量体を形成することを明らかにしたが、さらに6量体を形成した抗体分子と抗原性分子が結合した様子を可視化し、その結果から結合速度定数を求めることに成功した。
H. Kominami, K. Kobayashi, S. Ido, H. Kimiya, H. Yamada RSC Advances 8, 29378 (2018).
DNA複合体
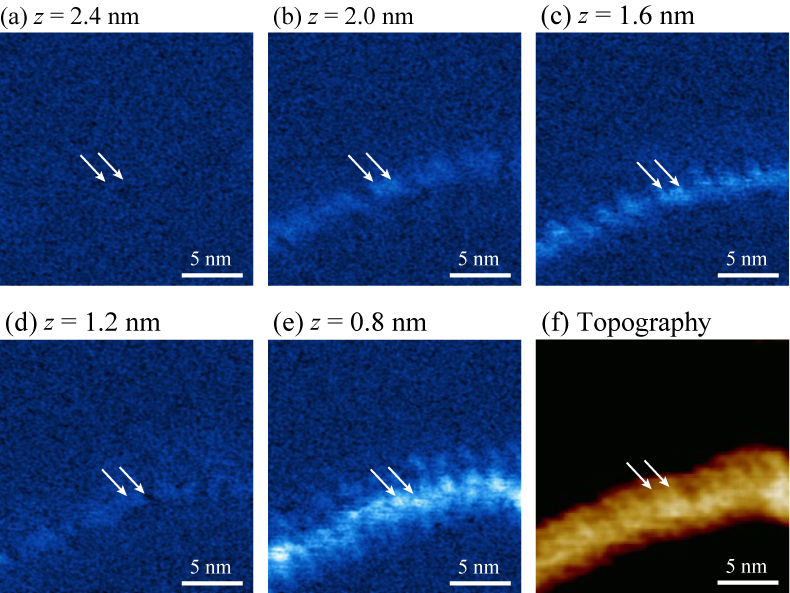
DNAは、生体機能における根幹であり、さまざまなタンパク質と結合する。真核生物DNAの複製開始時には、最初に複製を許可する反応が生じるが、その際にMCMと呼ばれるリング状のタンパク質がDNAに結合する。DNAとMCMの結合様式はこれまで詳細が明らかになっていなかったが、AFMを用いて観察することで、DNAがリング状のMCMをどのように通り抜けているか可視化することに成功した。
K. Hizume, H. Kominami, K. Kobayashi, H. Yamada, H. Araki Biochemistry 56, 2435 (2017).
膜タンパク質の機能解析
細胞膜は細胞内外の物質輸送や信号伝達において非常に重要な役割を持つ。生体膜に吸着し、イオンチャネルやプロトンポンプなどとして機能するタンパク質は数多く存在する。Annexin A5と呼ばれるタンパク質は脂質膜上において2次元結晶を形成することで、細胞膜が損傷した際に傷口の拡大を防ぐ役割を担っている。われわれはFM-AFMを用いることでAnnexin A5 2次元結晶のサブ分子スケール構造観察に成功した。
生体分子周囲の水和殻可視化
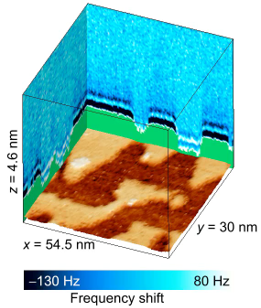
DNA近傍における水分子はDNAとタンパク質の結合において大きく寄与していると考えられている。われわれの研究室では、非常に高感度なFM-AFMを用いた3次元フォースマッピング法により固体界面における水分子の秩序だった構造 (水和構造) を可視化してきた。しかし、3次元フォースマッピング法は通常の表面形状観察とは異なり、試料垂直方向にも探針を走査するため測定に時間を要する。そのため、熱ドリフトなどの影響を受けやすくなることが知られており、試料面内方向の分解能が低下する。われわれはこれまでの試料垂直方向に探針を走査する3次元フォースマッピング法に加え、高さ一定モードを利用した3次元的な測定を行うことで、より詳細な水分子密度分布測定を行うことを可能とした。DNA分子について3次元的な水和構造計測を行った結果、DNAのバックボーンを構成するリン酸基上において水分子が構造化していることを明らかにした。
生体分子上の局所電荷密度計測・分子周囲のイオン分布可視化
生体分子活性部における表面電荷密度は、その機能発現に大きく影響していると考えられているため、生体分子の表面電荷密度計測手法が広く求められている。しかし、液中環境下における電荷計測は大気・真空中とは異なり、溶液中のイオンや水分子の影響を受けてしまうため、非常に困難であることが知られている。そこでわれわれのグループはFM-AFMを用いることにより、微弱な力を検出することで、生体分子であるDNAに対して表面電荷密度計測を行い、通常の右巻きDNAに対し、左巻きDNAの表面電荷密度が異なることを明らかにした。この結果はDNAとタンパク質の結合メカニズム解明に大きく寄与すると期待される。
H. Kominami, K. Kobayashi, H. Yamada Scientific Reports 9, 6851 (2019).

生体分子揺らぎの3次元可視化
生体分子は非常に柔らかい構造を有しており、溶液中において揺らいでいることが知られている。生体分子の揺らぎは生体分子同士の結合確率を向上させる上において、非常に重要な役割を担っていると言われている。FM-AFMでは、カンチレバーの励振に必要なエネルギー (散逸エネルギー) を計測することで、試料の揺らぎや粘性を測定することが可能である。われわれはカルサイト上においてFM-AFMによる3次元フォースマッピングを行うことで、散逸エネルギーからナノメートルスケールでの水の粘性を可視化することに成功した。今後、生体分子への応用や散逸エネルギー計測による揺らぎ計測が期待される。
K. Umeda, K. Kobayashi, T. Minato, H. Yamada Physical Review Letters 122, 116001 (2019).